Monografía de los Modelos Atómicos: Historia, Tipos y Relevancia en la Química
Introducción a la fascinante historia de los modelos atómicos
La historia de los modelos atómicos es como un viaje a través del tiempo, donde cada parada nos revela un poco más sobre la naturaleza de la materia y cómo entendemos el universo. Desde las primeras especulaciones filosóficas de los griegos hasta los sofisticados modelos cuánticos de hoy, la evolución del concepto de átomo es un testimonio del ingenio humano. Pero, ¿qué es exactamente un modelo atómico? En esencia, es una representación que nos ayuda a visualizar y comprender la estructura y el comportamiento de los átomos. Imagina que los modelos atómicos son como mapas del tesoro: nos guían a través de un mundo invisible, mostrándonos cómo interactúan los componentes fundamentales de la materia. Así que, abróchate el cinturón, porque en este recorrido vamos a explorar la historia, los tipos y la relevancia de los modelos atómicos en la química.
Los Primeros Pasos: La Antigüedad y la Filosofía Griega
Todo comenzó en la antigua Grecia, donde filósofos como Demócrito y Leucipo introdujeron la idea de que la materia está compuesta por pequeñas partículas indivisibles llamadas «átomos». Para ellos, los átomos eran como pequeñas esferas en constante movimiento, y aunque su teoría no tenía base experimental, sentaron las bases para el pensamiento científico. Pero, ¿quién podría haber imaginado que esta idea, que parecía tan simple, se convertiría en un pilar fundamental de la química moderna?
Demócrito y su visión atómica
Demócrito, alrededor del año 400 a.C., propuso que los átomos eran eternos, indestructibles y que variaban en forma y tamaño. Imagínate una caja de herramientas: cada herramienta (o átomo) tiene su propia función, pero juntas pueden construir algo increíble. Aunque su concepto fue rechazado durante siglos en favor de las teorías más filosóficas de Aristóteles, la idea de que todo está compuesto de átomos nunca desapareció del todo.
El Renacimiento Científico y la Revolución Química
Avancemos unos mil años hasta el Renacimiento, cuando la curiosidad por el mundo natural comenzó a florecer de nuevo. En el siglo XVIII, figuras como Antoine Lavoisier y John Dalton comenzaron a experimentar y observar la materia de una manera más sistemática. Lavoisier, conocido como el padre de la química moderna, introdujo la ley de conservación de la masa, que afirma que la masa no se crea ni se destruye, solo se transforma. Esto fue como abrir una puerta a un nuevo mundo, donde los átomos empezaron a tener un papel más central en la química.
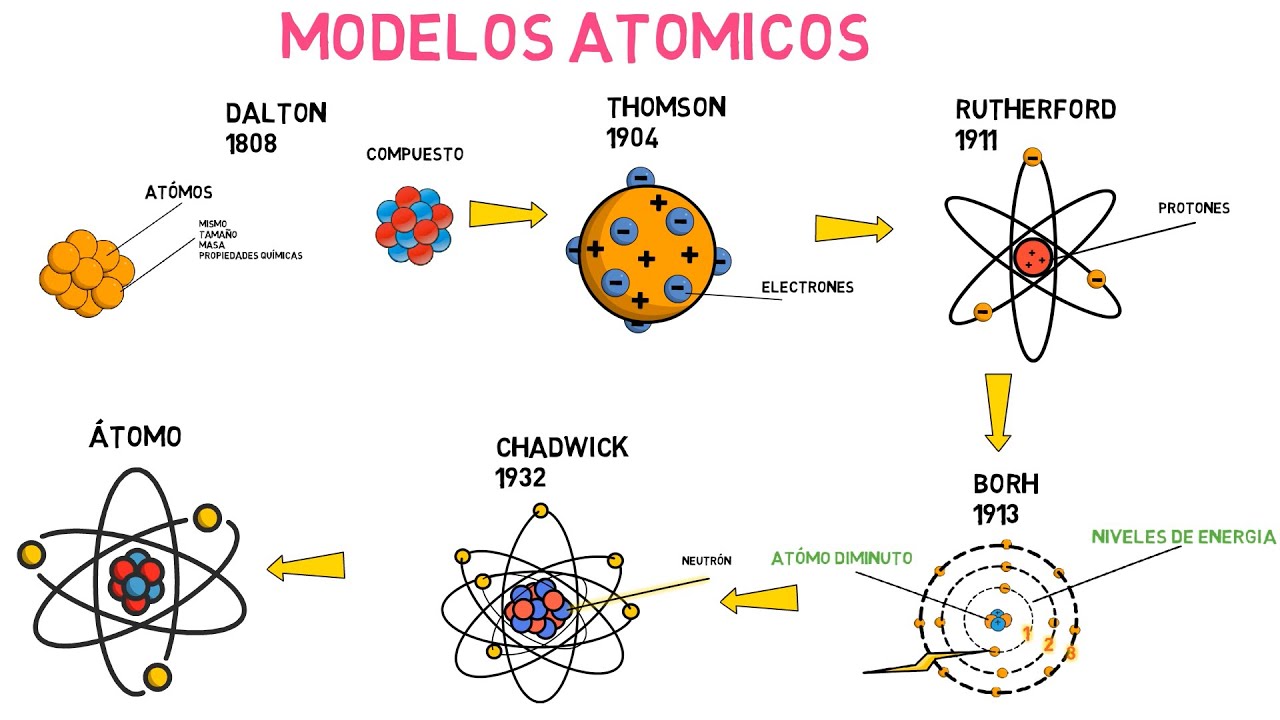
La teoría atómica de Dalton
John Dalton, en 1803, tomó el relevo y presentó su propia teoría atómica, que era un verdadero hito. Imagina que Dalton fue el primero en dibujar un mapa detallado del tesoro: propuso que cada elemento estaba compuesto por átomos de un tipo particular y que los compuestos se formaban mediante la combinación de diferentes átomos. Su modelo, aunque simplista, fue un gran avance, ya que proporcionó una base para entender las reacciones químicas. Pero, ¿qué pasaba con esos átomos? ¿Eran realmente indivisibles?
La Era de los Electrones: Thomson y el Modelo del Pudín de Ciruelas
En 1897, J.J. Thomson realizó un experimento que cambiaría la forma en que vemos los átomos. Al descubrir el electrón, demostró que los átomos no eran indivisibles, como había propuesto Dalton. En lugar de eso, imaginó un modelo donde los electrones estaban incrustados en una «sopa» de carga positiva, como ciruelas en un pudín. Este modelo, aunque innovador, fue rápidamente cuestionado. ¿Era realmente suficiente para explicar la complejidad del átomo?
El modelo de Rutherford: Un núcleo en el centro
La respuesta llegó en 1911 con Ernest Rutherford, quien, a través de su famoso experimento de la lámina de oro, demostró que la mayor parte de la masa del átomo está concentrada en un núcleo pequeño y denso, rodeado de electrones que orbitan a su alrededor. Imagina un sistema solar en miniatura, donde el núcleo es el sol y los electrones son los planetas. Este modelo fue revolucionario, pero aún había preguntas sin respuesta. ¿Cómo podían los electrones, que deberían perder energía al orbitar, no caer en el núcleo?
La Mecánica Cuántica y el Modelo Atómico Moderno
La respuesta a esta pregunta llegó con la llegada de la mecánica cuántica en la década de 1920. Niels Bohr propuso un modelo que incorporaba conceptos cuánticos, sugiriendo que los electrones ocupan niveles de energía específicos y que solo pueden moverse entre ellos al absorber o emitir energía. Esto fue como darle un nuevo traje a los electrones, permitiéndoles bailar en sus órbitas sin caer en el núcleo. Sin embargo, a medida que avanzaba la investigación, se hizo evidente que el modelo de Bohr no podía explicar todos los fenómenos observados, especialmente para átomos más complejos.
El modelo cuántico: una nueva visión del átomo
Finalmente, el modelo cuántico de la mecánica ondulatoria, desarrollado por científicos como Schrödinger y Heisenberg, nos proporcionó una visión más precisa del átomo. En lugar de órbitas fijas, los electrones son descritos por «nubes de probabilidad», lo que significa que podemos saber dónde es más probable encontrar un electrón en un momento dado, pero no su posición exacta. Esto es como tratar de atrapar humo: sabes que está ahí, pero no puedes tocarlo directamente. Este modelo ha revolucionado nuestra comprensión de la química y la física, abriendo nuevas puertas a la investigación y la tecnología.
La Relevancia de los Modelos Atómicos en la Química Actual
Ahora que hemos recorrido la historia de los modelos atómicos, es importante preguntarnos: ¿por qué son relevantes hoy en día? La respuesta es simple: la química, la biología, la física y muchas otras ciencias dependen de nuestra comprensión de los átomos y cómo interactúan entre sí. Los modelos atómicos no solo nos ayudan a entender la estructura de la materia, sino que también son esenciales para el desarrollo de nuevas tecnologías, medicamentos y materiales.
Aplicaciones en la vida cotidiana
Desde la creación de nuevos fármacos hasta el desarrollo de materiales más eficientes, la comprensión de los átomos y sus interacciones es crucial. Por ejemplo, la química detrás de los medicamentos que tomamos se basa en cómo los átomos se combinan y reaccionan. ¿Alguna vez te has preguntado cómo un simple comprimido puede aliviar un dolor de cabeza? Todo se reduce a la forma en que los átomos interactúan en nuestro cuerpo. Además, en el ámbito de la tecnología, la investigación en nanotecnología y materiales avanzados se basa en la manipulación de átomos y moléculas.
El Futuro de la Investigación Atómica
Mirando hacia el futuro, la investigación atómica sigue siendo un campo emocionante y en constante evolución. Con el avance de la tecnología, como la microscopía de electrones y la espectroscopía, los científicos están cada vez más capacitados para explorar la estructura atómica y molecular de maneras que antes eran impensables. ¿Quién sabe qué descubrimientos nos esperan? Tal vez en el futuro, podamos ver y manipular átomos de maneras que hoy solo podemos imaginar.
Preguntas Frecuentes
- ¿Qué es un modelo atómico? Un modelo atómico es una representación que describe la estructura y el comportamiento de los átomos, ayudándonos a entender cómo interactúan y se combinan en la materia.
- ¿Por qué es importante estudiar los modelos atómicos? Los modelos atómicos son fundamentales para la química y otras ciencias, ya que nos permiten comprender la composición de la materia, las reacciones químicas y el desarrollo de nuevas tecnologías.
- ¿Quiénes fueron los principales contribuyentes a la teoría atómica? Algunos de los principales contribuyentes incluyen a Demócrito, John Dalton, J.J. Thomson, Ernest Rutherford y Niels Bohr, cada uno de los cuales aportó ideas clave a la comprensión de los átomos.
- ¿Qué es la mecánica cuántica y cómo se relaciona con los modelos atómicos? La mecánica cuántica es una rama de la física que estudia el comportamiento de las partículas a nivel atómico y subatómico, proporcionando un marco teórico para comprender la estructura y el comportamiento de los átomos.
- ¿Cómo afectan los modelos atómicos a nuestra vida cotidiana? Los modelos atómicos influyen en diversos aspectos de nuestra vida, desde los medicamentos que tomamos hasta la tecnología que usamos, ya que nos ayudan a entender cómo interactúan los átomos en diferentes contextos.
Este artículo ofrece un recorrido detallado sobre la historia, tipos y relevancia de los modelos atómicos en la química, utilizando un estilo conversacional y accesible. Además, incluye preguntas frecuentes para profundizar aún más en el tema.