Todo lo que Debes Saber sobre la Ley de los Proporciones Definidas: Conceptos y Ejemplos
Introducción a la Ley de los Proporciones Definidas
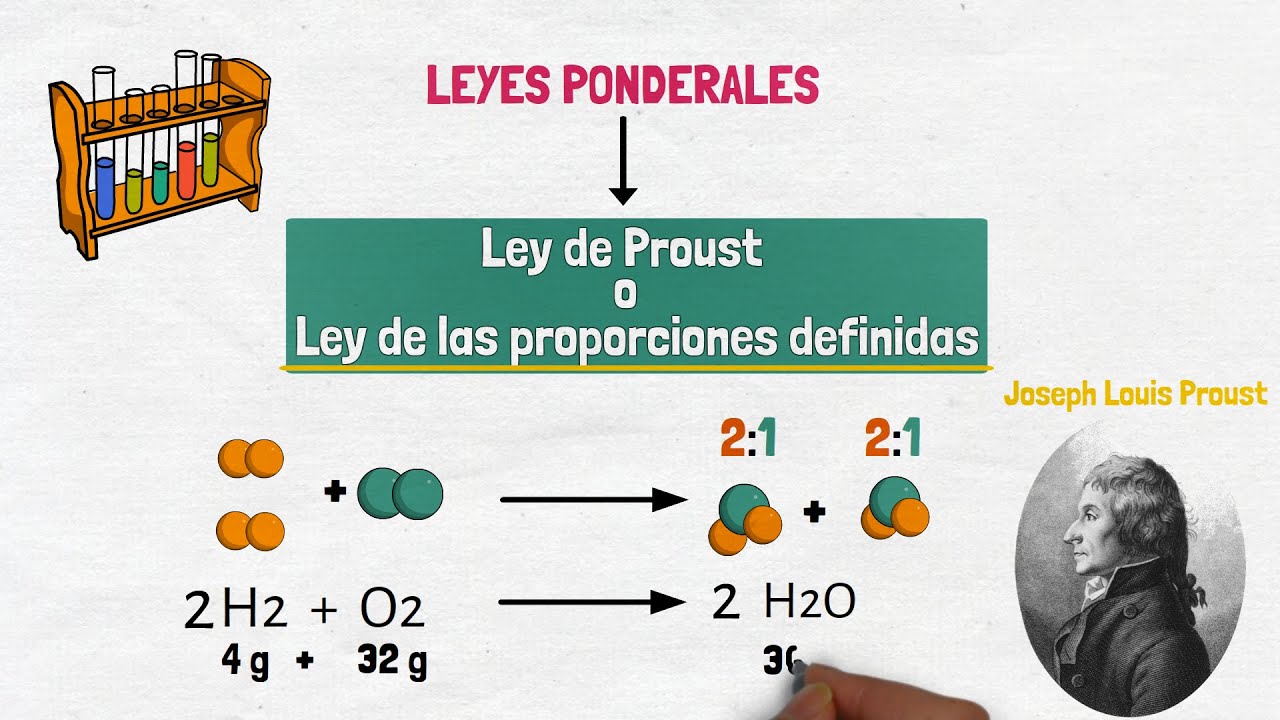
¡Hola! Hoy vamos a sumergirnos en un tema fascinante que tiene mucho que ver con la química y la forma en que entendemos el mundo a nuestro alrededor: la Ley de los Proporciones Definidas. Esta ley, también conocida como la ley de Proust, nos dice que un compuesto químico siempre está formado por los mismos elementos en proporciones fijas. Por ejemplo, si tomas agua (H2O), siempre encontrarás que está compuesta por dos átomos de hidrógeno y uno de oxígeno. No importa de dónde provenga el agua, ¡siempre tendrá esa misma proporción! Es como si tuvieras una receta de cocina que debes seguir al pie de la letra; si cambias las cantidades, el resultado final no será el mismo.
¿Alguna vez has hecho un pastel y te has dado cuenta de que te faltaba un ingrediente clave? Eso puede arruinar todo el proceso. De manera similar, la Ley de los Proporciones Definidas establece que los elementos en un compuesto deben estar en proporciones específicas para que ese compuesto mantenga sus propiedades químicas. Así que, ¡prepárate para explorar este concepto con ejemplos, aplicaciones y un poco de historia detrás de esta fascinante ley!
Un Poco de Historia
Para entender completamente la Ley de los Proporciones Definidas, es importante saber de dónde viene. La ley fue formulada por el químico francés Joseph Proust a finales del siglo XVIII. Proust, a través de una serie de experimentos, demostró que los compuestos químicos se formaban de elementos en proporciones constantes. Imagina que es como un detective, juntando pistas para resolver un misterio; Proust reunió la evidencia necesaria para validar su teoría.
Su trabajo fue crucial para el desarrollo de la química moderna, ya que sentó las bases para entender cómo se combinan los elementos. Esto no solo ayudó a establecer una base sólida para la química, sino que también inspiró a otros científicos a investigar más sobre la naturaleza de los compuestos químicos. Sin Proust y su ley, nuestra comprensión de la química podría haber tomado un rumbo muy diferente.
¿Qué es la Ley de los Proporciones Definidas?
Ahora que tenemos un poco de contexto histórico, ¿qué es exactamente la Ley de los Proporciones Definidas? En términos simples, esta ley establece que un compuesto químico siempre está compuesto por los mismos elementos en proporciones fijas. Esto significa que, sin importar cómo o dónde se forme un compuesto, la relación entre los elementos que lo componen no cambiará. ¡Es como tener un código secreto que nunca cambia!
Por ejemplo, el dióxido de carbono (CO2) siempre tendrá un átomo de carbono y dos átomos de oxígeno. Si alguna vez encuentras un compuesto que no sigue esta regla, ¡es un indicio de que algo no está bien! Este principio es fundamental para la química porque permite a los científicos predecir cómo reaccionarán los compuestos y cómo se comportarán en diferentes condiciones.
Ejemplos de la Ley de los Proporciones Definidas
Para ilustrar mejor esta ley, vamos a ver algunos ejemplos prácticos. Imagina que estás cocinando y decides hacer un batido de plátano. Para mantener el sabor constante, siempre utilizas un plátano, una taza de leche y dos cucharadas de azúcar. Si cambias la cantidad de plátano, el sabor del batido cambiará. De la misma manera, en química, un compuesto como el agua siempre tendrá su proporción fija de hidrógeno y oxígeno. Si cambias esa proporción, obtendrás un compuesto completamente diferente, como el peróxido de hidrógeno (H2O2), que tiene propiedades muy distintas.
Ejemplo 1: Agua (H2O)
Como mencionamos antes, el agua es un ejemplo clásico. Siempre que encuentres agua, encontrarás que tiene dos átomos de hidrógeno y uno de oxígeno. Esto se mantiene constante en cualquier lugar del planeta, desde los océanos hasta los ríos. Si te encuentras con agua que tiene una proporción diferente, es posible que estés mirando algo más que agua.
Ejemplo 2: Sal (NaCl)
Otro buen ejemplo es la sal común, que está compuesta por sodio (Na) y cloro (Cl). La relación en la que estos dos elementos se combinan es siempre 1:1, formando el cloruro de sodio (NaCl). Si tuvieras más o menos de uno de estos elementos, no tendrías sal, ¡tendrías otra cosa por completo!
¿Por Qué es Importante esta Ley en la Química?
La Ley de los Proporciones Definidas no es solo un concepto académico; tiene aplicaciones prácticas que son fundamentales en diversas áreas de la química y la ciencia en general. Por ejemplo, en la industria farmacéutica, la creación de medicamentos requiere una precisión extrema en la mezcla de compuestos. Si los componentes no están en las proporciones correctas, el medicamento podría no funcionar o, peor aún, podría ser dañino.
Además, en la investigación científica, esta ley ayuda a los científicos a comprender las reacciones químicas. Al saber que los compuestos se forman en proporciones específicas, pueden predecir cómo reaccionarán diferentes sustancias entre sí. Es como tener un mapa que te guía a través de un laberinto complicado.
Relación con Otras Leyes Químicas
La Ley de los Proporciones Definidas está relacionada con otras leyes en la química que también son fundamentales para entender cómo funcionan los compuestos. Una de estas es la Ley de Conservación de la Masa, formulada por Antoine Lavoisier, que dice que la masa total de los reactivos en una reacción química es igual a la masa total de los productos. Esta ley complementa la Ley de los Proporciones Definidas, ya que ambas se basan en la idea de que los elementos se combinan de maneras específicas y predecibles.
La Ley de las Proporciones Múltiples
Otra ley interesante es la Ley de las Proporciones Múltiples, que se refiere a situaciones donde dos elementos pueden combinarse de diferentes maneras para formar compuestos diferentes. Por ejemplo, el carbono y el oxígeno pueden combinarse para formar monóxido de carbono (CO) y dióxido de carbono (CO2). Aquí es donde la Ley de los Proporciones Definidas entra en juego, ya que cada compuesto tiene su propia proporción fija de elementos.
Aplicaciones en la Vida Cotidiana
La Ley de los Proporciones Definidas no solo se aplica en laboratorios o fábricas; también tiene un impacto en nuestra vida diaria. Desde la cocina hasta la agricultura, esta ley se manifiesta en muchas de nuestras actividades cotidianas. Por ejemplo, cuando cocinamos, es esencial seguir las proporciones de los ingredientes para que los platillos resulten sabrosos. Si decides poner más sal de la necesaria, ¡podrías arruinar el sabor de la comida!
En el ámbito de la agricultura, los fertilizantes se diseñan con proporciones específicas de nutrientes para asegurar que las plantas crezcan de manera saludable. Si no se aplican en las cantidades correctas, las plantas pueden no obtener lo que necesitan para prosperar.
Preguntas Frecuentes
1. ¿Qué pasaría si los elementos en un compuesto no estuvieran en proporciones definidas?
Si los elementos no están en proporciones definidas, el compuesto resultante podría tener propiedades completamente diferentes y no se comportaría como se espera. Podría ser inestable o incluso peligroso.
2. ¿Cómo se relaciona la Ley de los Proporciones Definidas con la química orgánica?
En la química orgánica, esta ley sigue siendo crucial, ya que los compuestos orgánicos también están formados por elementos en proporciones específicas. Esto permite a los químicos predecir el comportamiento de compuestos complejos.
3. ¿La Ley de los Proporciones Definidas se aplica a todos los compuestos?
Sí, esta ley se aplica a todos los compuestos químicos, tanto orgánicos como inorgánicos. Siempre que un compuesto esté formado por elementos, estos estarán en proporciones definidas.
4. ¿Por qué es importante seguir esta ley en la industria farmacéutica?
En la industria farmacéutica, seguir la Ley de los Proporciones Definidas es crucial para garantizar la efectividad y seguridad de los medicamentos. Las proporciones incorrectas pueden llevar a medicamentos ineficaces o peligrosos.
5. ¿Puede la Ley de los Proporciones Definidas cambiar en condiciones extremas?
No, la Ley de los Proporciones Definidas se mantiene constante independientemente de las condiciones. Sin embargo, los compuestos pueden descomponerse o reaccionar de maneras diferentes bajo condiciones extremas.
Así que ahí lo tienes, un recorrido por la Ley de los Proporciones Definidas, un concepto fundamental en la química que nos ayuda a entender el mundo que nos rodea. ¿Te ha resultado útil esta información? ¿Hay algo más que te gustaría saber sobre la química y sus leyes? ¡Déjanos tus comentarios!