Todo sobre la Ley de las Proporciones Definidas de Proust: Fundamentos y Aplicaciones
Introducción a la Ley de Proust
La química es un mundo fascinante lleno de reglas y leyes que nos ayudan a entender cómo interactúan las sustancias entre sí. Una de estas leyes, que ha dejado una huella indeleble en la historia de la ciencia, es la Ley de las Proporciones Definidas, formulada por el químico francés Joseph Proust a principios del siglo XIX. Pero, ¿qué significa realmente esta ley? En términos simples, Proust nos dice que un compuesto químico siempre está formado por los mismos elementos en las mismas proporciones, sin importar cómo se haya obtenido. Imagina que estás horneando un pastel. Siempre que sigas la receta, usarás la misma cantidad de harina, azúcar y huevos, independientemente de si decides hacer un pastel grande o uno pequeño. Esta analogía refleja lo que Proust descubrió: la consistencia en la composición de los compuestos químicos.
La Ley de Proust es fundamental para entender la química moderna, ya que establece las bases para el estudio de las reacciones químicas y la composición de los compuestos. Pero, ¿cómo se llegó a esta conclusión? ¿Y cuáles son las aplicaciones prácticas de esta ley en nuestra vida cotidiana? Acompáñame en este recorrido para desentrañar los secretos de la Ley de las Proporciones Definidas y su impacto en el mundo de la ciencia.
El Contexto Histórico de la Ley de Proust
Para entender la Ley de las Proporciones Definidas, primero debemos ubicarnos en el contexto histórico en el que Proust hizo su descubrimiento. A finales del siglo XVIII y principios del XIX, la química estaba en una etapa de transformación. La teoría del flogisto, que había dominado el pensamiento químico, estaba siendo reemplazada por nuevas ideas sobre la naturaleza de los elementos y compuestos. En este clima de cambio, Proust, junto con otros científicos como Antoine Lavoisier, comenzó a investigar las reacciones químicas y la composición de las sustancias.
Proust realizó una serie de experimentos meticulosos en los que analizó diferentes compuestos, como el óxido de cobre y el carbonato de cobre. A través de estos experimentos, se dio cuenta de que, independientemente de cómo se preparara el compuesto, la proporción de los elementos que lo constituían siempre era la misma. Esto fue un hallazgo revolucionario que no solo desafió las teorías existentes, sino que también sentó las bases para la química moderna.
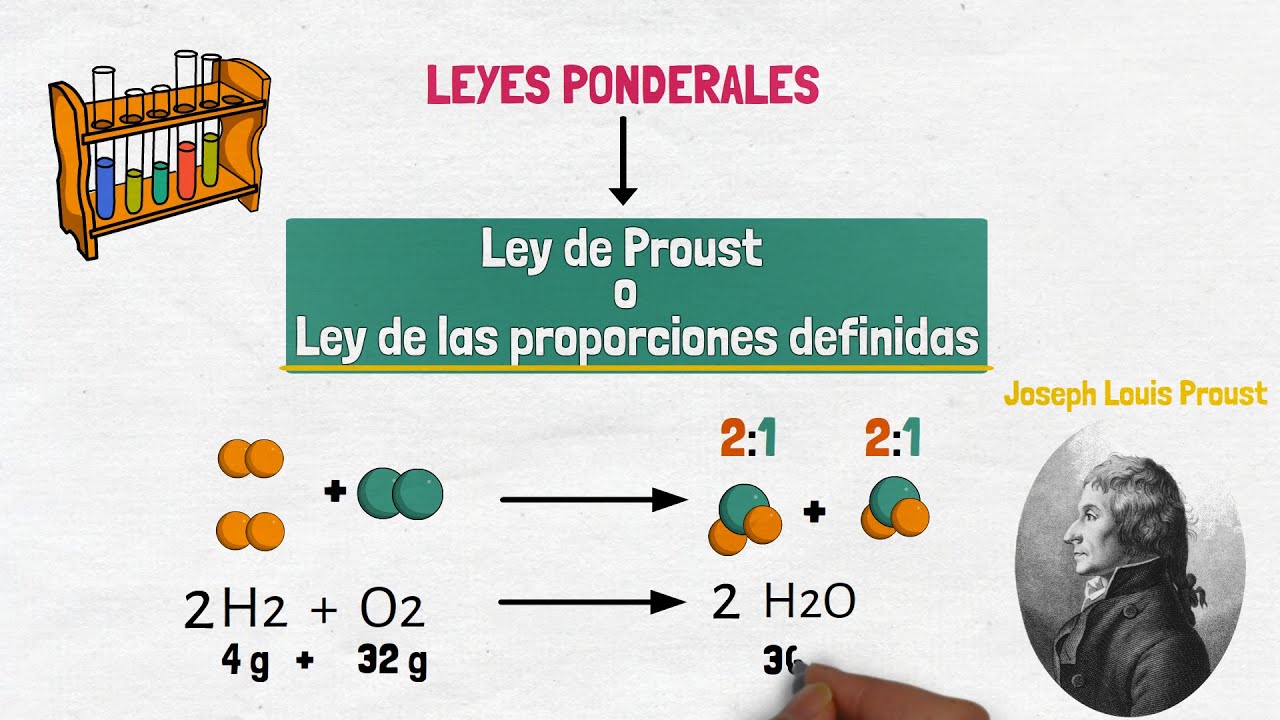
¿Qué es la Ley de las Proporciones Definidas?
Ahora que hemos establecido el contexto histórico, es hora de profundizar en lo que realmente significa la Ley de Proust. Esta ley afirma que un compuesto químico está formado por elementos en proporciones fijas y definidas. Por ejemplo, el agua (H₂O) siempre estará compuesta por dos átomos de hidrógeno y un átomo de oxígeno. No importa si el agua proviene de un río, de una botella o de un océano; su composición será siempre la misma.
Esto es esencialmente lo que diferencia a un compuesto de una mezcla. En una mezcla, los componentes pueden variar en proporciones; piensa en una ensalada donde puedes añadir más lechuga o más tomate según tu gusto. Pero en un compuesto, los ingredientes deben estar en una proporción específica para que mantenga sus propiedades químicas.
Ejemplos de la Ley de Proust en Acción
Para ilustrar mejor la Ley de Proust, consideremos algunos ejemplos concretos. Uno de los compuestos más conocidos es el cloruro de sodio, comúnmente conocido como sal de mesa. Este compuesto está formado por un átomo de sodio (Na) y un átomo de cloro (Cl) en una proporción de 1:1. No importa si obtienes sal de la evaporación del agua del mar o de un proceso químico en un laboratorio; siempre tendrás esta misma proporción.
Otro ejemplo es el dióxido de carbono (CO₂), que está compuesto por un átomo de carbono y dos átomos de oxígeno. En este caso, la proporción es de 1:2. Este tipo de consistencia en la composición es lo que permite a los científicos predecir cómo se comportarán los compuestos en diversas reacciones químicas.
La Importancia de la Ley de Proust en la Química
La Ley de las Proporciones Definidas de Proust no solo es un principio fundamental en química, sino que también tiene numerosas aplicaciones prácticas. Por ejemplo, en la industria farmacéutica, la precisión en la dosificación de los ingredientes activos es crucial. La ley garantiza que cada medicamento contenga la misma cantidad de cada componente, lo que es vital para su eficacia y seguridad.
Además, en la fabricación de materiales, como plásticos o aleaciones, la Ley de Proust asegura que las propiedades del material sean consistentes y predecibles. Esto es especialmente importante en la construcción de edificios y en la producción de dispositivos electrónicos, donde las especificaciones exactas son esenciales.
Relación con Otras Leyes de la Química
La Ley de Proust no opera en un vacío; está interconectada con otras leyes de la química. Por ejemplo, la Ley de las Proporciones Múltiples, propuesta por John Dalton, complementa la ley de Proust al afirmar que cuando dos elementos pueden formar más de un compuesto, las masas de un elemento que se combinan con una masa fija del otro están en una relación de números enteros simples. Esta ley refuerza la idea de que la composición de los compuestos químicos es específica y predecible.
Además, la Ley de Conservación de la Masa, formulada por Antoine Lavoisier, establece que la masa total de los reactivos en una reacción química debe ser igual a la masa total de los productos. Juntas, estas leyes forman la base de nuestra comprensión moderna de la química y son esenciales para el estudio de la materia y sus transformaciones.
Aplicaciones Cotidianas de la Ley de Proust
Ahora que hemos explorado la teoría detrás de la Ley de las Proporciones Definidas, es interesante considerar cómo se aplica en nuestra vida diaria. Desde la cocina hasta la limpieza del hogar, la química está en todas partes, y la ley de Proust juega un papel importante en muchos de estos procesos.
En la Cocina
Cuando cocinamos, a menudo seguimos recetas que requieren proporciones específicas de ingredientes. Si estás preparando una salsa, la cantidad de tomates, cebollas y especias debe ser precisa para lograr el sabor deseado. Esto se asemeja a la Ley de Proust, donde cada «receta» química tiene proporciones exactas para que el compuesto mantenga sus propiedades.
En Productos de Limpieza
Los productos de limpieza también dependen de la Ley de Proust. Por ejemplo, los detergentes están formulados con ingredientes en proporciones específicas para asegurar su eficacia. Si cambias la cantidad de un componente, puedes afectar la capacidad del detergente para eliminar manchas o suciedad. La química detrás de estos productos es un ejemplo perfecto de cómo la Ley de Proust se manifiesta en nuestra vida diaria.
Desafíos y Críticas a la Ley de Proust
A pesar de su importancia, la Ley de Proust no ha estado exenta de críticas y desafíos. Algunos científicos han señalado que en ciertas condiciones, como en reacciones complejas o en la formación de compuestos en estado gaseoso, las proporciones pueden variar. Sin embargo, estas excepciones no desvirtúan la validez de la ley en la mayoría de los casos. Es importante recordar que la ciencia está en constante evolución, y lo que aprendemos hoy puede ser refinado o ampliado en el futuro.
El Futuro de la Química y la Ley de Proust
Mirando hacia adelante, es emocionante pensar en cómo la Ley de las Proporciones Definidas seguirá influyendo en la investigación y la innovación en química. Con el auge de la química verde y la sostenibilidad, los científicos están buscando maneras de utilizar estos principios para desarrollar procesos más eficientes y menos dañinos para el medio ambiente. La Ley de Proust puede ser un faro que guíe estas nuevas exploraciones, asegurando que los compuestos se utilicen de manera responsable y efectiva.
Preguntas Frecuentes
1. ¿La Ley de Proust se aplica a todos los compuestos químicos?
Sí, la Ley de las Proporciones Definidas se aplica a todos los compuestos químicos, independientemente de su origen o método de preparación. Siempre que un compuesto esté formado por elementos, la proporción de esos elementos será constante.
2. ¿Cómo se relaciona la Ley de Proust con la química orgánica?
La Ley de Proust es fundamental en la química orgánica, ya que los compuestos orgánicos, como los hidrocarburos y los azúcares, también siguen esta ley. La comprensión de las proporciones en estos compuestos es crucial para su síntesis y aplicación.
3. ¿Qué pasaría si las proporciones de los elementos en un compuesto cambian?
Si las proporciones de los elementos en un compuesto cambian, se formará un nuevo compuesto con propiedades diferentes. Por ejemplo, si cambias la proporción de hidrógeno y oxígeno en el agua, no obtendrás agua, sino una mezcla que no tendrá las mismas propiedades.
4. ¿La Ley de Proust tiene aplicaciones en la medicina?
Sí, la Ley de Proust es crucial en la medicina, especialmente en la formulación de medicamentos. La precisión en la dosificación de los ingredientes activos es vital para la eficacia y seguridad de los tratamientos.
5. ¿Puede la Ley de Proust ser violada en condiciones extremas?
En condiciones extremas, como en reacciones altamente energéticas o en ciertos estados de la materia, puede haber variaciones en las proporciones. Sin embargo, estas son excepciones y no deslegitiman la ley en condiciones normales.
En resumen, la Ley de las Proporciones Definidas de Proust es un principio fundamental que ha moldeado nuestra comprensión de la química. Desde su formulación en el siglo XIX hasta sus aplicaciones modernas, esta ley sigue siendo una piedra angular en el estudio de los compuestos químicos y sus interacciones. Así que la próxima vez que cocines o uses un producto de limpieza, recuerda que la química está detrás de todo, y la Ley de Proust es una de sus protagonistas. ¡La ciencia nunca ha sido tan interesante!