Fórmula para Calcular la Masa Atómica de un Elemento: Guía Paso a Paso
Introducción a la Masa Atómica
La masa atómica es un concepto fundamental en la química que nos ayuda a entender cómo se comportan los elementos en la naturaleza. ¿Alguna vez te has preguntado cómo se determina la masa de un elemento? Bueno, la respuesta no es tan complicada como parece. En este artículo, te llevaré a través de un viaje fascinante y educativo donde desglosaremos el proceso de cálculo de la masa atómica de un elemento. Así que, ¡prepara tus lápices y papel, porque vamos a sumergirnos en el mundo de la química!
¿Qué es la Masa Atómica?
Primero, hablemos sobre qué es exactamente la masa atómica. En términos simples, la masa atómica de un elemento es la masa promedio de los átomos de ese elemento, medida en unidades de masa atómica (uma o daltons). Este valor tiene en cuenta la abundancia de los isótopos del elemento y su masa. Imagina que la masa atómica es como una receta de cocina: tienes diferentes ingredientes (isótopos) que, en diferentes proporciones, crean un platillo (la masa atómica). ¿Te imaginas preparar un plato sin saber las cantidades de cada ingrediente? ¡Sería un desastre!
Los Isótopos y su Importancia
Ahora, hablemos de los isótopos. Los isótopos son variantes de un mismo elemento que tienen el mismo número de protones pero diferente número de neutrones. Por ejemplo, el carbono tiene isótopos como el carbono-12 y el carbono-14. Aunque ambos son carbono, su masa es diferente debido a la cantidad de neutrones. La masa atómica promedio de un elemento se calcula considerando la masa y la abundancia de cada isótopo. Así que, si alguna vez te has preguntado por qué la masa atómica de un elemento no es un número entero, ¡ahí tienes la respuesta!
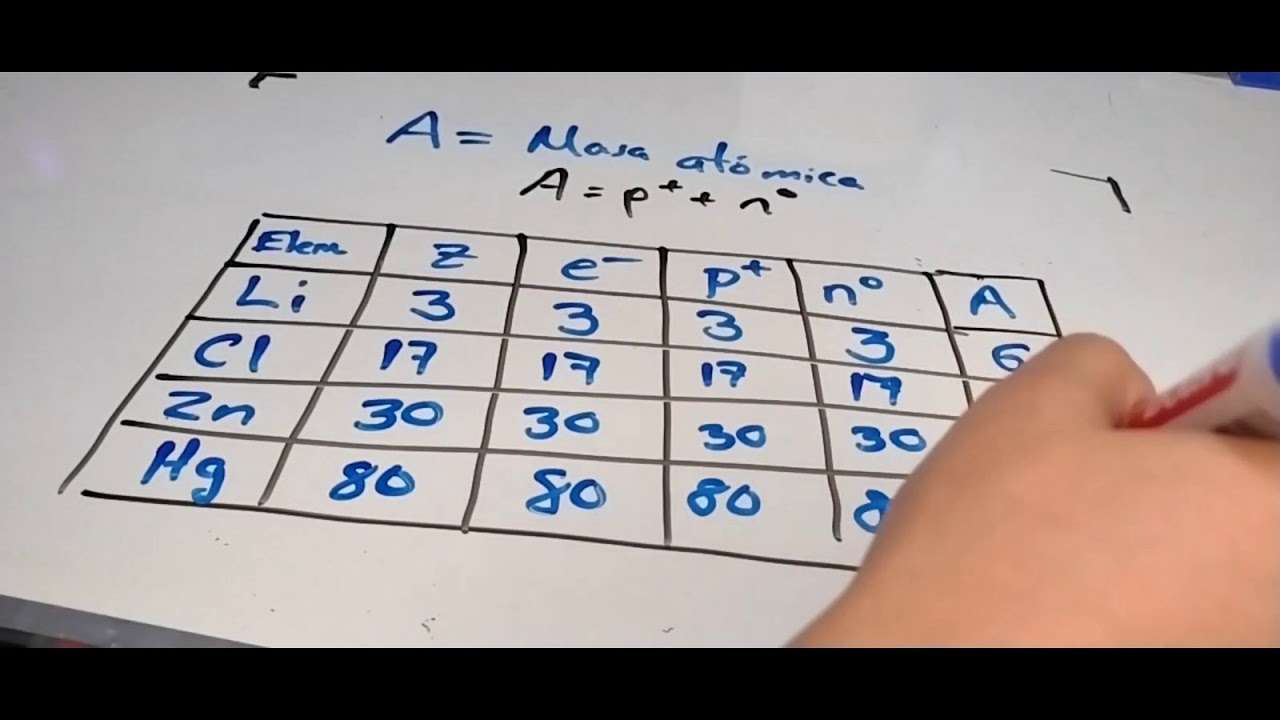
Fórmula para Calcular la Masa Atómica
Ahora que entendemos qué es la masa atómica y la importancia de los isótopos, pasemos a la parte emocionante: cómo calcularla. La fórmula básica que utilizamos es la siguiente:
Masa Atómica = (Masa Isótopo 1 × Abundancia Isótopo 1) + (Masa Isótopo 2 × Abundancia Isótopo 2) + …
Esto significa que multiplicamos la masa de cada isótopo por su abundancia relativa (generalmente expresada como un decimal) y luego sumamos todos esos valores. ¿Te parece complicado? ¡No te preocupes! Vamos a desglosarlo con un ejemplo práctico.
Ejemplo Práctico: Calcular la Masa Atómica del Carbono
Imaginemos que queremos calcular la masa atómica del carbono. Sabemos que el carbono tiene dos isótopos principales: carbono-12 y carbono-14. Supongamos que sus masas son 12 uma y 14 uma, respectivamente, y que su abundancia es la siguiente:
- Carbono-12: 98.89%
- Carbono-14: 1.11%
Primero, convertimos las abundancias a decimales:
- Carbono-12: 0.9889
- Carbono-14: 0.0111
Ahora, aplicamos la fórmula:
Masa Atómica = (12 uma × 0.9889) + (14 uma × 0.0111)
Realizando las multiplicaciones:
- Carbono-12: 11.8668 uma
- Carbono-14: 0.1554 uma
Sumando ambos resultados:
Masa Atómica ≈ 12.021 uma
Y así es como obtenemos la masa atómica del carbono, que es aproximadamente 12.01 uma. ¡Fácil, verdad?
Factores que Afectan la Masa Atómica
Ahora que sabemos cómo calcular la masa atómica, es importante entender que varios factores pueden influir en ella. La abundancia de isótopos puede cambiar debido a procesos naturales o artificiales, como la radiactividad o la fusión nuclear. Por ejemplo, en la naturaleza, el carbono-14 se produce en la atmósfera y es utilizado por los científicos para datar restos orgánicos. A medida que se acumula el carbono-14 en un organismo, su masa atómica promedio se ve afectada. ¿No es fascinante cómo la química está conectada con la historia de la Tierra?
Aplicaciones de la Masa Atómica en la Vida Cotidiana
La masa atómica no solo es un concepto teórico; tiene aplicaciones prácticas en nuestra vida diaria. Por ejemplo, en la medicina, se utiliza en la radioterapia para tratar el cáncer. Los isótopos radiactivos se emplean para destruir células cancerosas, y entender su masa atómica es crucial para calcular las dosis adecuadas. También se utiliza en la industria para la fabricación de materiales y en la investigación científica. Así que, cada vez que escuchas sobre un avance médico o un nuevo material, ¡recuerda que la masa atómica está detrás de todo eso!
Preguntas Frecuentes
¿Por qué la masa atómica de algunos elementos no es un número entero?
La masa atómica no es un número entero porque es un promedio ponderado de las masas de los isótopos de un elemento, teniendo en cuenta su abundancia relativa. Como hemos visto, los isótopos tienen diferentes masas, y al calcular la masa atómica, estamos considerando esas diferencias.
¿Cómo se determina la abundancia de los isótopos?
La abundancia de los isótopos se determina mediante técnicas como la espectrometría de masas. Este método permite separar y medir la cantidad de cada isótopo en una muestra, lo que proporciona datos precisos sobre su abundancia relativa.
¿Qué sucede si un elemento tiene más de dos isótopos?
Si un elemento tiene más de dos isótopos, simplemente se agrega un término adicional a la fórmula de masa atómica. La fórmula se convierte en una suma de todos los isótopos disponibles, cada uno multiplicado por su abundancia relativa.
¿La masa atómica cambia con el tiempo?
La masa atómica de un elemento en la tabla periódica se considera constante en condiciones normales. Sin embargo, la abundancia de isótopos puede cambiar con el tiempo debido a procesos naturales, como la desintegración radiactiva, lo que puede afectar la masa atómica promedio en ciertas circunstancias.
¿Por qué es importante conocer la masa atómica?
Conocer la masa atómica es fundamental para realizar cálculos químicos, como la estequiometría, que nos ayuda a entender cómo reaccionan los elementos entre sí. Además, es crucial para aplicaciones en campos como la medicina, la industria y la investigación científica.
En resumen, la masa atómica es un concepto clave que conecta la teoría química con aplicaciones prácticas en el mundo real. A través de este artículo, hemos explorado cómo calcularla, qué factores la afectan y por qué es tan importante en nuestra vida diaria. Así que la próxima vez que veas un elemento en la tabla periódica, ¡recuerda que detrás de cada número hay una historia fascinante que vale la pena contar!