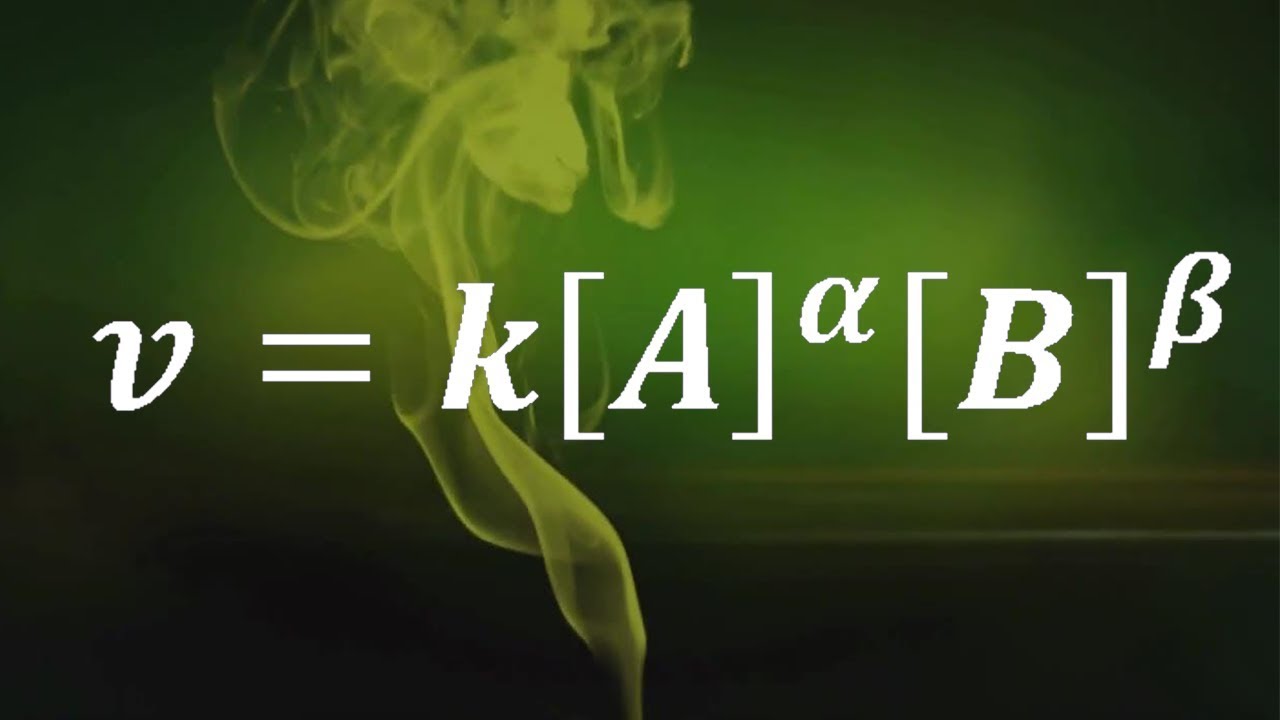Cómo Saber el Orden de una Reacción: Guía Paso a Paso para Estudiantes de Química
Introducción al Orden de Reacción
¿Alguna vez te has preguntado cómo los químicos pueden predecir la velocidad de una reacción? ¡Es todo un arte! El orden de una reacción es fundamental para entender la cinética química, y aunque puede parecer complicado al principio, con un poco de paciencia y algunos pasos simples, pronto te convertirás en un experto. Así que, si estás listo, vamos a desglosar este tema y hacerlo tan fácil como un pastel de chocolate. ¡Vamos a ello!
¿Qué es el Orden de una Reacción?
Primero, aclaremos qué significa el «orden de una reacción». En términos sencillos, el orden de una reacción se refiere a la forma en que la velocidad de la reacción química depende de las concentraciones de los reactivos. Se expresa en una ecuación conocida como la ecuación de velocidad. Por ejemplo, si tienes una reacción general:
[ aA + bB rightarrow productos ]
La ecuación de velocidad podría verse así:
[ v = k[A]^m[B]^n ]
Aquí, ( v ) es la velocidad de la reacción, ( k ) es la constante de velocidad, y ( m ) y ( n ) son los órdenes de reacción respecto a los reactivos A y B, respectivamente. ¿Te suena complicado? No te preocupes, lo desglosaremos paso a paso.
Pasos para Determinar el Orden de una Reacción
1. Realiza Experimentos de Velocidad
El primer paso para determinar el orden de una reacción es llevar a cabo experimentos de velocidad. Aquí es donde la magia comienza. Necesitarás medir la velocidad de la reacción a diferentes concentraciones de reactivos. Piensa en esto como cocinar: si quieres que tu pastel suba, necesitas ajustar los ingredientes y ver qué sucede.
Para hacer esto, puedes usar métodos como la espectrofotometría o la titulación para medir cómo cambia la concentración de los reactivos o productos con el tiempo. Anota todos tus datos porque los necesitarás más adelante.
2. Construye una Tabla de Datos
Una vez que hayas recopilado tus datos, el siguiente paso es organizarlos en una tabla. Esto es crucial, ya que te ayudará a visualizar cómo las concentraciones de los reactivos afectan la velocidad de la reacción. Imagina que estás creando un mapa del tesoro; cada dato es un paso que te lleva a la solución.
Tu tabla debería incluir columnas para las concentraciones de los reactivos y la velocidad de la reacción correspondiente. Asegúrate de que sea clara y fácil de leer.
3. Determina la Relación entre Velocidad y Concentración
Ahora que tienes tus datos, es hora de jugar a detective. Observa cómo cambia la velocidad de la reacción al variar las concentraciones de los reactivos. Para esto, puedes hacer un análisis gráfico o simplemente mirar los números. ¿Notas algún patrón?
Por ejemplo, si duplicar la concentración de A duplica la velocidad de la reacción, entonces A tiene un orden de 1. Si al duplicar A la velocidad se cuadruplica, entonces A tiene un orden de 2. Este es el momento en que todo comienza a cobrar sentido, como encontrar la pieza que falta en un rompecabezas.
4. Usa la Ley de Velocidad
Ahora que has observado las relaciones, puedes aplicar la ley de velocidad. Este es el momento en que puedes empezar a escribir la ecuación de velocidad de la reacción. Recuerda que la ecuación se verá algo así:
[ v = k[A]^m[B]^n ]
Donde ( m ) y ( n ) son los órdenes que has determinado en el paso anterior. ¿Ves cómo todo se conecta? Es como juntar las piezas de un rompecabezas, cada parte encaja para revelar el cuadro completo.
Ejemplo Práctico
Vamos a ilustrar todo este proceso con un ejemplo práctico. Imagina que estás investigando la reacción entre el ácido clorhídrico (HCl) y el carbonato de sodio (Na2CO3). Realizas varios experimentos y obtienes los siguientes datos:
| [HCl] (M) | [Na2CO3] (M) | Velocidad (mol/s) |
|———–|—————|——————–|
| 0.1 | 0.1 | 0.01 |
| 0.2 | 0.1 | 0.04 |
| 0.1 | 0.2 | 0.02 |
| 0.2 | 0.2 | 0.08 |
Al analizar estos datos, puedes notar que al duplicar la concentración de HCl, la velocidad se cuadruplica. Esto sugiere que el orden respecto a HCl es 2. Por otro lado, al duplicar la concentración de Na2CO3, la velocidad se duplica, lo que sugiere que el orden respecto a Na2CO3 es 1.
Por lo tanto, la ecuación de velocidad para esta reacción sería:
[ v = k[HCl]^2[Na2CO3]^1 ]
¡Felicidades! Ahora sabes cómo determinar el orden de una reacción a través de un ejemplo práctico.
Consideraciones Finales
Entender el orden de una reacción no solo es esencial para los exámenes de química, sino que también tiene aplicaciones en la vida real. Desde la producción de medicamentos hasta la fabricación de alimentos, conocer cómo reaccionan las sustancias químicas puede marcar la diferencia.
Recuerda que la práctica es clave. Cuanto más experimentes y analices, más cómodo te sentirás con estos conceptos. Así que no dudes en hacer tus propios experimentos en casa (con la supervisión adecuada, por supuesto) y ver qué descubres.
Preguntas Frecuentes
1. ¿Qué pasa si el orden de una reacción es cero?
El orden cero significa que la velocidad de la reacción es constante y no depende de la concentración de los reactivos. Esto puede ocurrir en ciertas reacciones donde, por ejemplo, la reacción está limitada por la superficie de un catalizador.
2. ¿El orden de una reacción siempre coincide con los coeficientes estequiométricos?
No necesariamente. El orden de reacción se determina experimentalmente y puede ser diferente de los coeficientes estequiométricos. Por ejemplo, una reacción puede tener un orden de 2 respecto a un reactivo, aunque su coeficiente en la ecuación química sea 1.
3. ¿Cómo se relaciona el orden de reacción con la constante de velocidad?
La constante de velocidad (k) está relacionada con el orden de reacción y la temperatura. A medida que el orden de reacción aumenta, la constante de velocidad puede cambiar, afectando la rapidez con la que ocurre la reacción.
4. ¿Se puede tener un orden fraccionario en una reacción?
Sí, es posible. Un orden fraccionario indica que la relación entre la velocidad de reacción y la concentración de un reactivo no es lineal. Esto puede ocurrir en reacciones complejas donde intervienen múltiples pasos.
5. ¿Cuál es la importancia del orden de reacción en la industria química?
Conocer el orden de reacción permite a los químicos optimizar procesos, aumentar la eficiencia y reducir costos en la producción de productos químicos, medicamentos y más.
Así que ahí lo tienes, una guía completa sobre cómo saber el orden de una reacción. ¡Espero que te haya resultado útil y que te sientas más seguro en tus estudios de química! ¿Listo para experimentar y descubrir más? ¡Adelante!