Cómo Saber la Masa de un Átomo: Guía Paso a Paso para Estudiantes de Química
Introducción a la Masa Atómica
¿Alguna vez te has preguntado cómo los científicos pueden determinar la masa de un átomo? Es una pregunta fascinante y, aunque pueda parecer complicado al principio, en realidad es un proceso bastante accesible. En esta guía, desglosaremos todo lo que necesitas saber sobre la masa atómica, desde los conceptos básicos hasta los métodos utilizados para calcularla. Así que, si estás listo, ¡vamos a sumergirnos en el mundo de la química!
¿Qué es la Masa Atómica?
La masa atómica es, de manera simple, la medida de la masa de un átomo. Se expresa en unidades de masa atómica (uma), y se refiere a la masa promedio de los isótopos de un elemento, ponderada según su abundancia natural. Para entenderlo mejor, imagina que estás en un mercado de frutas. Si tienes diferentes tipos de manzanas, algunas más grandes y otras más pequeñas, la masa atómica sería como el promedio del peso de todas esas manzanas, teniendo en cuenta cuántas de cada tipo tienes. Es una forma de simplificar y representar una característica compleja de los átomos.
Los Componentes de un Átomo
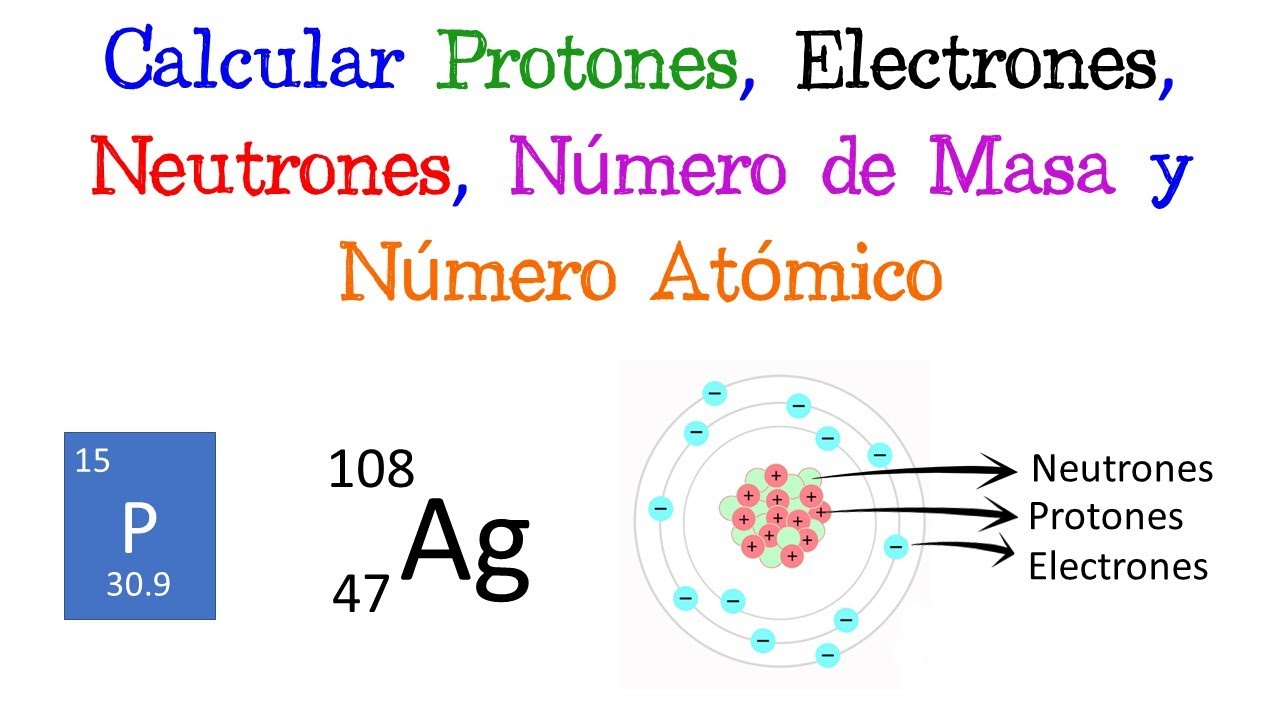
Para calcular la masa de un átomo, primero debemos entender sus componentes. Cada átomo está compuesto por protones, neutrones y electrones. Los protones y neutrones se encuentran en el núcleo del átomo y son responsables de la mayor parte de la masa atómica. Los electrones, aunque son esenciales para la química, tienen una masa tan pequeña que a menudo se ignoran en los cálculos de masa atómica. Así que, si te imaginas un átomo como un pequeño sistema solar, los protones y neutrones serían el sol en el centro, mientras que los electrones giran a su alrededor, pero apenas aportan peso.
Protones y Neutrones
Los protones tienen una carga positiva y una masa de aproximadamente 1 uma, mientras que los neutrones no tienen carga y también tienen una masa similar. Por otro lado, los electrones tienen una masa mucho menor, alrededor de 1/1836 de una uma, por lo que su contribución a la masa total del átomo es casi despreciable. Si consideramos un átomo de carbono, por ejemplo, que tiene 6 protones y 6 neutrones, su masa atómica sería aproximadamente 12 uma, sin contar los electrones. ¡Así que ya ves cómo los protones y neutrones son los verdaderos pesos pesados!
Cómo Calcular la Masa Atómica
Ahora que ya sabemos qué es la masa atómica y cuáles son sus componentes, es hora de aprender a calcularla. Existen diferentes métodos, pero el más común es el uso de la tabla periódica. Cada elemento tiene su masa atómica listada, que es un promedio de las masas de sus isótopos. Para calcular la masa atómica de un elemento, puedes seguir estos pasos:
Paso 1: Identificar el Elemento
Lo primero que debes hacer es identificar el elemento cuyo masa atómica deseas calcular. Por ejemplo, si quieres saber la masa del oxígeno, buscarías el símbolo «O» en la tabla periódica.
Paso 2: Consultar la Tabla Periódica
Una vez que encuentres el símbolo del elemento, mira la cifra que está debajo de él. Esta cifra es la masa atómica promedio del elemento. En el caso del oxígeno, su masa atómica es aproximadamente 16 uma.
Paso 3: Considerar los Isótopos
Es posible que te encuentres con elementos que tienen varios isótopos. Un isótopo es una variante de un elemento que tiene el mismo número de protones pero un número diferente de neutrones. Por ejemplo, el carbono tiene tres isótopos: carbono-12, carbono-13 y carbono-14. La masa atómica que ves en la tabla periódica es un promedio ponderado de estos isótopos, teniendo en cuenta su abundancia natural. Si quieres ser más preciso en tus cálculos, necesitarías conocer las masas y abundancias de cada isótopo.
Ejemplo Práctico: Cálculo de la Masa Atómica del Carbono
Para hacer esto más claro, veamos un ejemplo práctico. Supongamos que queremos calcular la masa atómica del carbono. Sabemos que:
- Carbono-12 tiene una masa de 12 uma y representa el 98.89% de los átomos de carbono en la naturaleza.
- Carbono-13 tiene una masa de 13 uma y representa el 1.11% de los átomos de carbono.
- Carbono-14, aunque es un isótopo radiactivo, tiene una masa de 14 uma, pero su abundancia es tan baja que no se considera en el promedio.
Para calcular la masa atómica promedio, multiplicamos la masa de cada isótopo por su porcentaje de abundancia (en forma decimal) y sumamos los resultados:
Masa atómica = (12 uma * 0.9889) + (13 uma * 0.0111)
= 11.867 + 0.1443
= 12.0113 uma
Así que, en promedio, la masa atómica del carbono es aproximadamente 12.01 uma, que es el valor que ves en la tabla periódica.
Importancia de la Masa Atómica en Química
Conocer la masa atómica de un elemento es crucial en química. Te permite realizar cálculos estequiométricos, que son fundamentales para entender las reacciones químicas. Por ejemplo, si estás trabajando en una reacción que involucra oxígeno y hidrógeno, saber sus masas atómicas te ayudará a calcular cuántos gramos de cada uno necesitas para obtener la cantidad deseada de agua.
Relación con la Estequiometría
La estequiometría es el arte de medir y calcular las proporciones de reactivos y productos en una reacción química. Si no tienes en cuenta la masa atómica, sería como intentar cocinar sin seguir una receta: podrías terminar con un plato completamente diferente al que tenías en mente. Así que, para evitar sorpresas en el laboratorio, siempre asegúrate de tener a mano la tabla periódica y familiarízate con las masas atómicas de los elementos que estás utilizando.
Preguntas Frecuentes
1. ¿Por qué los electrones no se consideran en la masa atómica?
Los electrones tienen una masa tan pequeña que su contribución total a la masa atómica es prácticamente despreciable. Por eso, en la mayoría de los cálculos, solo se consideran protones y neutrones.
2. ¿Cómo afecta la masa atómica a las propiedades químicas de un elemento?
La masa atómica influye en la reactividad de un elemento, su estado físico y su comportamiento en reacciones químicas. Elementos con masas atómicas similares pueden tener propiedades químicas similares, pero no siempre es así.
3. ¿Es la masa atómica la misma que el peso atómico?
La masa atómica y el peso atómico son términos que a menudo se utilizan indistintamente, pero técnicamente no son lo mismo. La masa atómica es la masa de un átomo en unidades de masa atómica, mientras que el peso atómico es un promedio ponderado de la masa de los isótopos de un elemento, considerando su abundancia.
4. ¿Puedo calcular la masa de un átomo si no tengo acceso a una tabla periódica?
Si no tienes una tabla periódica a la mano, puedes buscar en línea, ya que hay muchas aplicaciones y sitios web que te ofrecen información sobre elementos y sus masas atómicas. Sin embargo, es fundamental tener una tabla periódica en el estudio de la química.
5. ¿Qué sucede si un elemento tiene muchos isótopos?
Cuando un elemento tiene muchos isótopos, su masa atómica promedio puede ser más compleja de calcular. Sin embargo, la tabla periódica ya proporciona este promedio, lo que simplifica mucho el proceso para los estudiantes y profesionales.
Así que ahí lo tienes, una guía completa sobre cómo saber la masa de un átomo. Ahora que tienes el conocimiento y las herramientas, ¡estás listo para sumergirte en el emocionante mundo de la química!